月4日,中國學者在Nature連續發表了6項成果,涉及生命科學,天文學,地球科學等不同的領域,iNature系統介紹這些成果:【1】混合譜系白血病(MLL)家族的甲基轉移酶 - 包括MLL1,MLL2,MLL3,MLL4,SET1A和SET1B-在賴氨酸4(H3K4)上實現組蛋白H3的甲基化,并且在造血,脂肪生成和發育中的轉錄調節中具有關鍵和獨特的作用。目前關于MLL活性調節的知識僅限于組蛋白H3肽的催化,以及H3K4甲基標記如何沉積在核小體上的知識知之甚少。2019年9月4日,上海交通大學醫學院第九人民醫院Huang Jing(第一單位為中科院上海生化細胞所)在Nature 在線發表題為“Structural basis of nucleosome recognition and modification by MLL methyltransferases”的研究論文,該研究報告人類MLL1和MLL3催化模塊與核小體核心顆粒(含有H2BK120ub1或未修飾的H2BK120)的冷凍電子顯微鏡結構,這些結構證明MLL1和MLL3復合物都與核小體的組蛋白折疊和DNA區域廣泛接觸,這樣可以輕松獲得組蛋白H3尾部,這對于H3K4的有效甲基化至關重要。H2B-綴合的泛素化的蛋白直接結合RBBP5,利于MLL1或MLL3與核小體之間的結合。MLL1和MLL3復合物在WDR5,RBBP5和MLL1(或相應的MLL3)亞基之間的界面處顯示不同的結構組織,這解釋了WDR5在調節兩種酶的活性中的相反作用。這些發現改變了我們對在核小體水平上調節MLL活性的結構基礎的理解,并突出了核小體調節在組蛋白尾部修飾中的關鍵作用。最后,英國弗朗西斯克里克研究所Steven J. Gamblin在Nature 發表題為”A key to unlocking chromatin revealed by complex structures“的點評文章,該文章系統總結了該研究的成果,同時指出了未來的研究應該揭示這種復合物的動態結合模式的生物學相關性。【2】分子時鐘估計預測,在冰凍期或埃迪卡拉時期,雙翅目動物會發生分歧,并且在埃迪卡拉時期結束之前,許多雙翅目的分支已經分化。兩側對稱性動物起源代表了一種改變地球系統的進化創新。然而,除了少數例外,大多數已故埃迪卡拉ichnofossoss的生產者都是未知的,這導致了身體和痕跡化石記錄之間的斷開。2019年9月4日,中國科學院南京地質古生物研究所袁訓來及弗吉尼亞理工大學地球科學系Shuhai Xiao共同通訊在Nature在線發表題為“Death march of a segmented and trilobate bilaterian elucidates early animal evolution”的研究論文,該研究描述了晚期埃迪卡拉時期(可追溯到551-539百萬年前)的兩側對稱性動物化石,研究人員將其命名為Yilingia spiciformis。這個尸體化石隨著動物在死亡游行中產生的蹤跡而被保存。Yilingia是一個細長的分段雙面體,具有重復的三葉形體單元,每個單元由一個中央葉和兩個后指向的側翼組成,表明體和片段的極性。 Yilingia可能與panarthropods或annelids有關,并揭示了兩側對稱性動物的分割起源。作為為數不多的Ediacaran動物之一,證明它已經產生了長而連續的小徑,Yilingia提供了對負責Ediacaran微量化石的動物身份的見解。【3】類星體是星系中心(或核)特別明亮的物體,被認為是通過將氣體吸收到超大質量黑洞周圍的圓盤中產生的。然而,對實際到達吸積盤的流入的明確觀察是難以捉摸的。2019年9月4日,中國極地研究中心周宏巖,中國科學院國家天文臺袁為民及中國科學技術大學王挺貴共同通訊在Nature 在線發表題為“Fast inflows as the adjacent fuel of supermassive black hole accretion disks in quasars”的研究論文,該研究報告在類星體樣本中檢測到紅移的氫和氦原子的寬吸收線。線條顯示寬范圍的多普勒速度,從零到紅移連續延伸,高達每秒約5,000公里。研究人員將此解釋為氣體向內運動的速度與接近黑洞的自由落體速度相當,將最快的氣體限制在黑洞的10,000重力半徑內。【4】剪接體在剪接循環期間順序形成E,A,前B,B,Bact,B *,C,C *,P和ILS復合物。除釀酒酵母(酵母)之外的所有剪接體復合物的冷凍電子顯微鏡(cryo-EM)結構在剪接周期的后期階段提供了有價值的信息。然而,缺乏對E復合物形成的結構和機理理解,E復合物是引發剪接循環的最早事件。因此,目前尚不清楚剪接機器如何準確定義內含子和外顯子。2019年9月4日,美國加州大學洛杉磯分校周正洪及科羅拉多大學Zhao Rui共同通訊在Nature 在線發表題為“A unified mechanism for intron and exon definition and back-splicing”的研究論文,該研究報告了在內含子上組裝的酵母剪接體E復合物的冷凍電子顯微鏡結構,提供了剪接周期中最早事件的圖譜,其將pre-mRNA轉化為剪接。 E復合物結構表明相同的剪接體可以跨越外顯子組裝,并且它要么重構以跨越內含子用于規范線性剪接(通常在短外顯子上)或催化反向剪接以產生環狀RNA(在長外顯子上)。這個簡單的模型在所有真核生物中通過相同的剪接體統一內含子定義,外顯子定義和反向剪接,并且應該激發許多其他系統中的實驗以理解這些過程的機制和調節。【5】甲型流感病毒是季節性流行病的原因,大流行病可能是由新型人畜共患A型流感病毒傳播給人類造成的。甲型流感病毒含有分段的負義RNA基因組,其由PB1,PB2和PA亞基組成的病毒RNA依賴性RNA聚合酶(FluPolA)轉錄和復制。盡管先前已報道過蝙蝠甲型流感病毒FluPolA的高分辨率晶體結構,但尚無人和禽流感FluPolA的完整結構。2019年9月4日,英國牛津大學Jonathan M. Grimes及Ervin Fodor(Haitian Fan為第一作者)共同通訊在Nature在線發表題為"Structures of influenza A virus RNA polymerase offer insight into viral genome replication"的研究論文,該研究使用晶體學和冷凍電子顯微鏡,確定人類甲型流感(H3N2)和禽流感A (H5N1)病毒的FluPolA結構,分辨率為3.0 -4.3Å(存在或不存在cRNA或vRNA模板)。在溶液中,FluPolA通過PA亞基的C末端結構域,PB1的拇指亞結構域和PB2的N1亞結構域形成異源三聚體的二聚體。與cRNA模板結合的單體FluPolA的冷凍電子顯微鏡結構揭示了二聚體界面處3'cRNA的結合位點。另外,研究人員還顯示干擾FluPolA二聚化的納米抗體抑制vRNA的合成,并因此抑制病毒在感染細胞中的復制。該研究提供了醫學相關FluPolA的高分辨率結構,以及對病毒RNA基因組復制機制的見解。此外,該工作確定了FluPolA中可能成為抗病毒藥物開發的系列靶標。【6】催化DNA中CpG甲基化的酶,包括DNA甲基轉移酶1(DNMT1),3A(DNMT3A)和3B(DNMT3B),對于哺乳動物組織發育和體內平衡是必不可少的。然而,控制基因間DNA甲基化的建立和維持的機制仍然知之甚少。Tatton-Brown-Rahman綜合征(TBRS)是一種兒童過度生長障礙,由DNMT3A中的種系突變定義。 TBRS與Sotos綜合征(由NSD1的單倍不足引起的臨床特征引起,NSD1是一種組蛋白甲基轉移酶,催化組蛋白H3在K36(H3K36me2)的二甲基化),這表明這兩種疾病之間存在機制聯系 。2019年9月4日,美國哥倫比亞大學Lu Chao,加拿大麥吉爾大學Jacek Majewski及洛克菲勒大學C. David Allis共同通訊在Nature在線發表題為"The histone mark H3K36me2 recruits DNMT3A and shapes the intergenic DNA methylation landscape"的研究論文,研究人員報告NSD1介導的H3K36me2是在基因間區域募集DNMT3A和維持DNA甲基化所必需的。全基因組分析顯示DNMT3A的結合和活性與常染色質的非編碼區域的H3K36me2共定位。在小鼠細胞中遺傳缺失Nsd1及其旁系同源物Nsd2導致DNMT3A重新分布至H3K36me3修飾的基因體并且減少基因間DNA的甲基化。來自患有Sotos綜合征和NSD1突變體腫瘤的患者的血液樣品也表現出基因間DNA的低甲基化。 DNMT3A的PWWP結構域在體外顯示H3K36me2和H3K36me3的雙重識別,對H3K36me2具有更高的結合親和力,其被TBRS衍生的錯義突變消除。總之,該研究揭示了一種跨染色質調節途徑,它將異常的基因間CpG甲基化與人類腫瘤和發育過度生長聯系起來。
1.MLL甲基轉移酶對核小體識別和修飾的結構基礎


混合譜系白血病(MLL)家族的甲基轉移酶 - 包括MLL1,MLL2,MLL3,MLL4,SET1A和SET1B-在賴氨酸4(H3K4)上實現組蛋白H3的甲基化,并且在造血,脂肪生成和發育中的轉錄調節中具有關鍵和獨特的作用。MLL蛋白的C末端催化SET(Su(變種)3-9,zeste和trithorax增強子)結構域與一組共同的調節因子(WDR5,RBBP5,ASH2L和DPY30)相關,以實現特定的活性。目前關于MLL活性調節的知識僅限于組蛋白H3肽的催化,以及H3K4甲基標記如何沉積在核小體上的知識知之甚少。
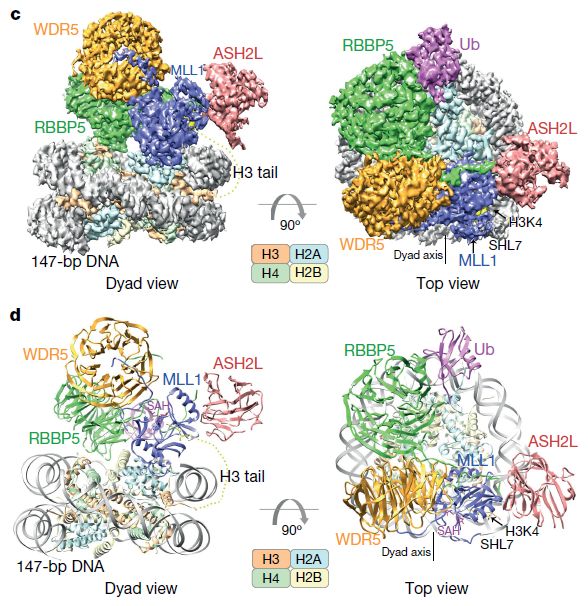
人類MLL1-ubNCP復合物的結構概述
組蛋白H2B在賴氨酸120(H2BK120ub1)上的單泛素化刺激H3K4甲基化,這是一種普遍的組蛋白H2B標記,破壞染色質壓縮并有利于開放的染色質結構,但潛在的機制仍然未知。
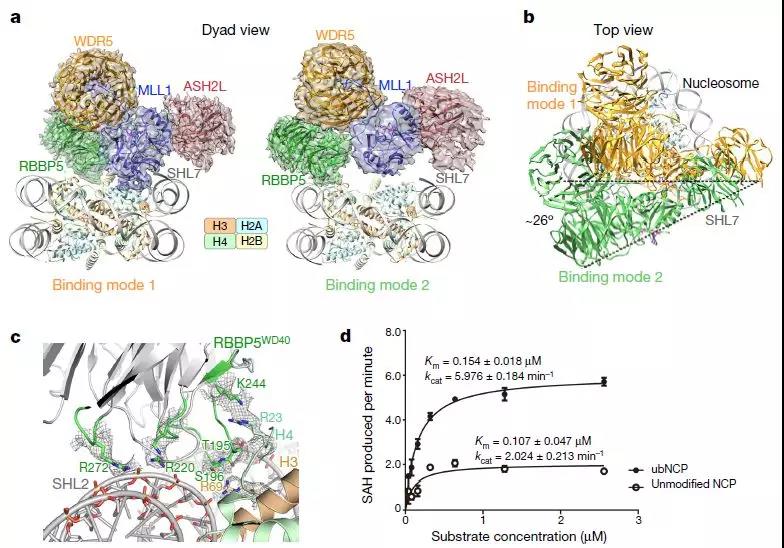
MLL1與未修飾的核小體復合Cryo-EM結構
在這里,研究人員報告人類MLL1和MLL3催化模塊與核小體核心顆粒(含有H2BK120ub1或未修飾的H2BK120)的冷凍電子顯微鏡結構,這些結構證明MLL1和MLL3復合物都與核小體的組蛋白折疊和DNA區域廣泛接觸;這樣可以輕松獲得組蛋白H3尾部,這對于H3K4的有效甲基化至關重要。H2B-綴合的泛素化的蛋白直接結合RBBP5,利于MLL1或MLL3與核小體之間的結合。MLL1和MLL3復合物在WDR5,RBBP5和MLL1(或相應的MLL3)亞基之間的界面處顯示不同的結構組織,這解釋了WDR5在調節兩種酶的活性中的相反作用。這些發現改變了我們對在核小體水平上調節MLL活性的結構基礎的理解,并突出了核小體調節在組蛋白尾部修飾中的關鍵作用。
參考信息:
https://www.nature.com/articles/s41586-019-1528-1
https://www.nature.com/articles/d41586-019-02593-6
2.早期的動物進化

分子時鐘估計預測,在冰凍期或埃迪卡拉時期,雙翅目動物會發生分歧,并且在埃迪卡拉時期結束之前,許多雙翅目的分支已經分化。如果正確的話,這些估計要求在埃迪卡拉時期存在兩側對稱性動物。兩側對稱性動物起源代表了一種改變地球系統的進化創新。這一創新可能發生在埃迪卡拉時代晚期 - 這一時期的大量痕跡化石(ichnofossils)證明了這一點,其中包括小徑,軌道和洞穴。然而,除了少數例外,大多數已故埃迪卡拉ichnofossoss的生產者都是未知的,這導致了身體和痕跡化石記錄之間的斷開。

身體化石
在這里,研究人員描述了晚期埃迪卡拉時期(可追溯到551-539百萬年前)的兩側對稱性動物化石,研究人員將其命名為Yilingia spiciformis。這個尸體化石隨著動物在死亡游行中產生的蹤跡而被保存。Yilingia是一個細長的分段雙面體,具有重復的三葉形體單元,每個單元由一個中央葉和兩個后指向的側翼組成,表明體和片段的極性。Yilingia可能與panarthropods或annelids有關,并揭示了兩側對稱性動物的分割起源。

Y. spiciformis的重建及其痕跡
作為為數不多的Ediacaran動物之一,證明它已經產生了長而連續的小徑,Yilingia提供了對負責Ediacaran微量化石的動物身份的見解。
參考信息:
https://www.nature.com/articles/s41586-019-1522-7
3.快速流入作為類星體中超大質量黑洞吸積盤的相鄰“燃料”

類星體是星系中心(或核)特別明亮的物體,被認為是通過將氣體吸收到超大質量黑洞周圍的圓盤中產生的。在銀河系和核周尺度上有觀測證據表明氣體內流向黑洞周圍的吸積盤,并且在圍繞中央吸積盤的塵埃環面上測量了這種流入量。
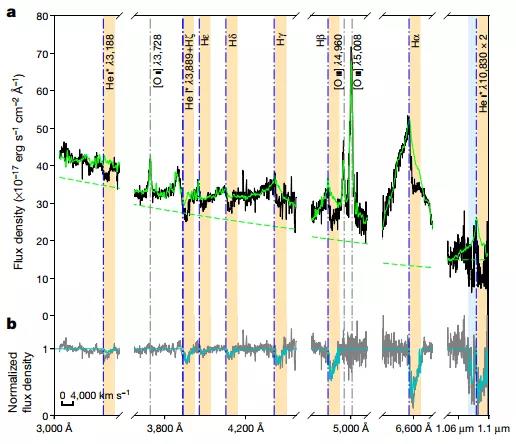
類星體JI035 + 1422的氫和氦吸收譜線
在更小的尺度上,已建議靠近吸積盤的流入量來解釋最近對氣態寬發射線連續變化的響應建模的結果。然而,對實際到達吸積盤的流入的明確觀察是難以捉摸的。

JI035 + 1422中總氫濃度空間中的概率密度分布和流入的特征徑向距離
在這里,研究人員報告在類星體樣本中檢測到紅移的氫和氦原子的寬吸收線。線條顯示寬范圍的多普勒速度,從零到紅移連續延伸,高達每秒約5,000公里。
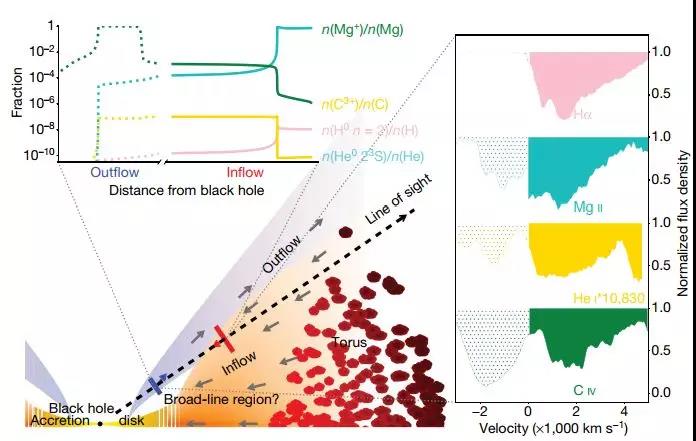
模式圖
研究人員將此解釋為氣體向內運動的速度與接近黑洞的自由落體速度相當,將最快的氣體限制在黑洞的10,000重力半徑內(重力半徑是重力常數乘以物體質量,除以光速的平方)。廣泛的光電離模擬產生大約1,000個重力半徑的流入的特征徑向距離,可能與外部吸積盤重疊。
參考信息:
https://www.nature.com/articles/s41586-019-1510-y
4.內含子和外顯子定義和反向剪接的統一機制

剪接體在剪接循環期間順序形成E,A,前B,B,Bact,B *,C,C *,P和ILS復合物。除釀酒酵母(酵母)之外的所有剪接體復合物的冷凍電子顯微鏡(cryo-EM)結構在剪接周期的后期階段提供了有價值的信息。然而,缺乏對E復合物形成的結構和機理理解,E復合物是引發剪接循環的最早事件。因此,目前尚不清楚剪接機器如何準確定義內含子和外顯子。
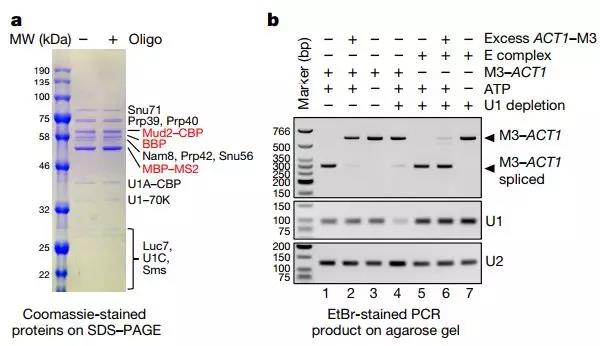
體外組裝的E復合物是功能性的
在酵母(通常含有小內含子和大外顯子)中,內含子定義,其中剪接體最初識別和組裝內含子,似乎占主導地位。另一方面,外顯子定義在脊椎動物中占優勢,其中小外顯子和大內含子是普遍的。在外顯子定義模型中,剪接體首先在外顯子上識別和組裝。然而,已經假設,為了拼出內含子,需要將外顯子定義復合物(EDC)重構為交叉內含子復合物。對外顯子定義模型的支持在很大程度上是間接的,并且外顯子定義過程的生物化學和結構分析是有限的。
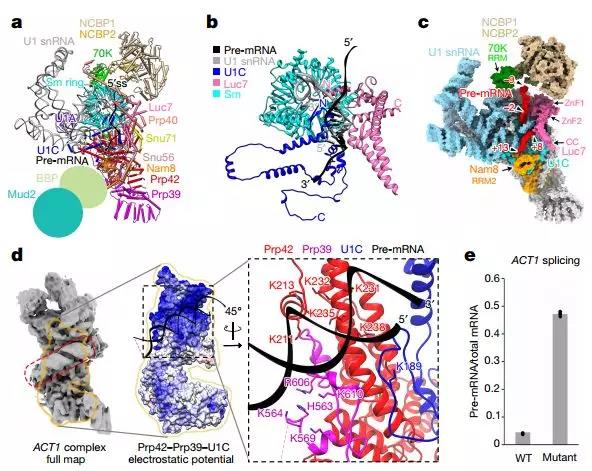
E復合物的Cryo-EM結構
除了典型的剪接外,一種特殊的反向剪接反應在不同的真核生物中產生一類環狀RNA(circRNA),促使人們推測反向剪接也是真核基因表達途徑的一個古老而保守的特征。 CircRNA參與其宿主基因或microRNA的調節,衰老和其他疾病過程。雖然規范剪接信號和剪接體是生成circRNAs所必需的,但反向剪接的確切參與者和機制仍然未知。
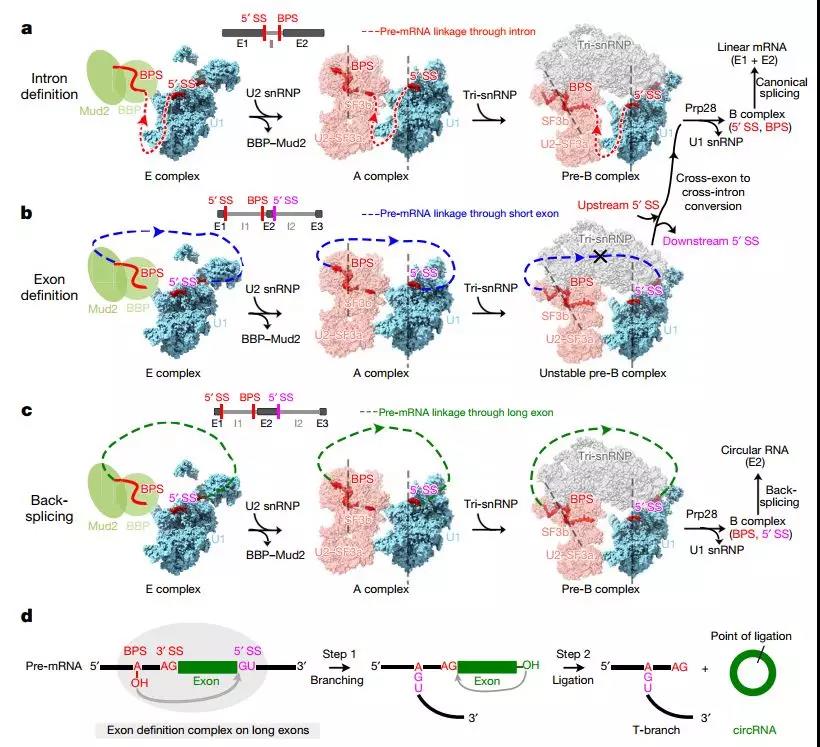
內含子定義,外顯子定義和反向拼接的統一模型
外顯子定義和反向剪接的分子機制是pre-mRNA剪接中尚未解決的基本問題。在這里,研究人員報告了在內含子上組裝的酵母剪接體E復合物的冷凍電子顯微鏡結構,提供了剪接周期中最早事件的圖譜,其將pre-mRNA轉化為剪接。
E復合物結構表明相同的剪接體可以跨越外顯子組裝,并且它要么重構以跨越內含子用于規范線性剪接(通常在短外顯子上)或催化反向剪接以產生環狀RNA(在長外顯子上)。該模型得到了實驗的支持,這些實驗表明,當外顯子足夠長時,在酵母EFM5或HMRA1的中間外顯子上組裝的E復合物可被追蹤成環狀RNA。這個簡單的模型在所有真核生物中通過相同的剪接體統一內含子定義,外顯子定義和反向剪接,并且應該激發許多其他系統中的實驗以理解這些過程的機制和調節。
參考信息:
https://www.nature.com/articles/s41586-019-1528-1
5.甲型流感病毒RNA聚合酶的結構提供了對病毒基因組復制的深入了解

甲型流感病毒是季節性流行病的原因,大流行病可能是由新型人畜共患A型流感病毒傳播給人類造成的。甲型流感病毒含有分段的負義RNA基因組,其由PB1,PB2和PA亞基組成的病毒RNA依賴性RNA聚合酶(FluPolA)轉錄和復制。盡管先前已報道過蝙蝠甲型流感病毒FluPolA的高分辨率晶體結構,但尚無人和禽流感FluPolA的完整結構。此外,病毒基因組RNA(vRNA)復制的分子機制 - 其通過互補RNA(cRNA)復制中間體進行,并且需要聚合酶的寡聚化仍然在很大程度上未知。
在這里,使用晶體學和冷凍電子顯微鏡,研究人員確定人類甲型流感/ NT / 60/1968(H3N2)和禽流感A /鴨/福建/ 01/2002(H5N1)病毒的FluPolA結構,分辨率為3.0 -4.3Å(存在或不存在cRNA或vRNA模板)。在溶液中,FluPolA通過PA亞基的C末端結構域,PB1的拇指亞結構域和PB2的N1亞結構域形成異源三聚體的二聚體。
與cRNA模板結合的單體FluPolA的冷凍電子顯微鏡結構揭示了二聚體界面處3'cRNA的結合位點。研究人員使用基于細胞的和體外測定的組合來顯示FluPolA二聚體的界面是病毒基因組復制期間vRNA合成所必需的。另外,研究人員還顯示干擾FluPolA二聚化的納米抗體抑制vRNA的合成,并因此抑制病毒在感染細胞中的復制。該研究提供了醫學相關FluPolA的高分辨率結構,以及對病毒RNA基因組復制機制的見解。此外,該工作確定了FluPolA中可能成為抗病毒藥物開發的系列靶標。





















