2019年6月11日,福建師范大學歐陽松應團隊在Nature Communications 在線發表題為“Two HEPN domains dictate CRISPR RNA maturation and target cleavage in Cas13d”的研究論文,該研究為進一步改造Cas13d蛋白作為核酸編輯及檢測工具,提供了扎實的結構基礎和理論依據;
2018年11月13日,福建師范大學歐陽松應團隊在Cell Research 在線發表“Structural insights into Cas13b-guided CRISPR RNA maturation and recognition”,該成果對認識與理解細菌抵抗RNA病毒入侵的分子基礎具有重要意義,為改造CRISPR-Cas13b系統其在RNA識別與編輯、核酸檢測領域的應用提供了結構生物學基礎;
2018年7月1日,福建師范大學歐陽松應等團隊在Structure上在線發表了題為“Crystal Structure of ATP-Bound Human ABCF1 Demonstrates a Unique Conformation of ABC Proteins”的研究論文,該研究分析了一個結合ATP的野生型人源ABCF 1的晶體結構(2.3-Å分辨率)。比較研究表明,該結構為預激活中間構象。這種構象是通過ATP與蛋白質的相互作用來穩定的。同時該研究也表明,這種構象是激活ABCF 1的一個重要步驟。本研究從分子水平擴展了我們對ABC蛋白激活的理解。

嗜肺軍團菌是一種引起肺炎的不典型致病菌,其引起的重癥肺炎俗稱“空調肺”。該菌能通過IV型分泌系統Dot/Icm分泌300多個效應蛋白到宿主細胞中,調控干擾宿主各種信號通路以輔助其自身在宿主細胞內的增殖。對這些效應蛋白的功能解析不僅有助于闡明了嗜肺軍團菌侵染宿主的分子機理,同時也能揭示新的細胞信號傳導方式和蛋白質翻譯后修飾模式【2】。眾所周知,泛素化修飾幾乎調控真核細胞的生命活動的所有方面3。在與宿主的長期博弈過程中,病原菌進化出了多種方式來干預宿主的泛素修飾系統,從而達到增強侵染效率和逃避宿主免疫監視的目的。2016年普渡大學羅招慶教授課題組在《Nature》雜志上首次報道了SidE家族效應蛋白獨立于經典的E1和E2酶的泛素化修飾的重大發現【4】,引發了廣泛關注【5-7】,該發現入選為當年度細胞信號傳遞領域的重大突破之一【8】。后續研究發現嗜肺軍團菌中的另一個效應蛋白SidJ可調控SdeA等SidE家族成員【9】,但其生化機制尚未清楚。
針對這一重要科學問題,中美兩國研究人員進行了聯合攻關。首先,通過質譜(LC-MS/MS)分析,發現SidJ誘導失活的SdeA發生129.01道爾頓的分子量漂移。進一步研究發現,SidJ能對SdeA進行谷氨酸化修飾,且 SdeA 被修飾的位點是位于其mART結構域中860位的谷氨酸殘基上,該位點是SdeAmART結構域催化的活性位點之一,主要負責水解NAD+,為泛素激活提供能量。更為有趣的是,研究者通過對SidJ序列分析,發現SidJ的C端具有一個結合CaM的保守IQ 結構域,CaM與SidJ結合形成穩定復合物,進而激活其酶活性(圖1)。
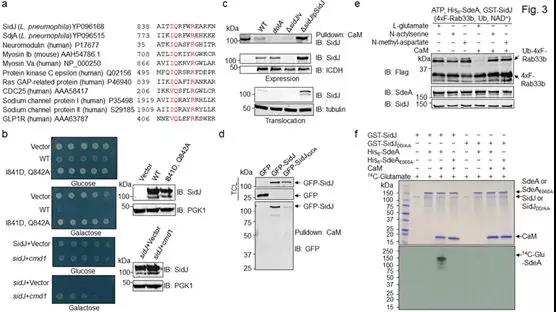
圖1 SidJ通過C端I841Q842 motif與CaM結合從而谷氨酸化SdeA
隨后研究人員解析了SidJ-CaM二元復合物以及SidJ-CaM結合AMP的三元復合物晶體結構(圖2),驚奇地發現SidJ的結構與在已知的真核生物中行使谷氨酸化修飾功能的tyrosine ligase-like(TTLL)家族酶完全不同【10】。結構解析顯示CaM能夠通過N-lobe和C-lobe與SidJ存在廣泛的結合。
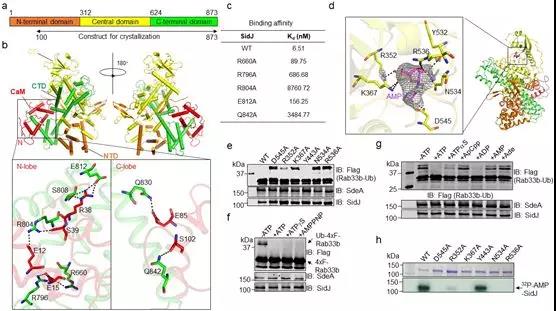
SidJ-CaM(PDB:6K4K)以及SidJ-CaM-AMP(PDB:6K4R)的晶體結構及不同的ATP類似小分子對其激活的能力
另外,SidJ-CaM 復合體結合一個AMP殘基,揭示SidJ是在a位磷酸切割ATP,從而通過酰化單磷酸腺苷化激活被修飾位點的谷氨酸殘基,異于常見的磷酸化激活。因此,g 位不能水解的類ATP分子仍能支持其活性。同時,在沒有SdeA的反應體系里,SidJ能發生AMP自修飾(self-AMPylation),進一步說明該反應由兩步特異的修飾完成(圖2)。在沒有受體基團的條件下,SidJ將源于ATP的AMP用于自修飾。綜合現有的研究結果,研究人員提出了SidJ結合宿主CaM催化SdeA的谷氨酸化修飾,進而導致SdeA失活的分子機制(圖3)。
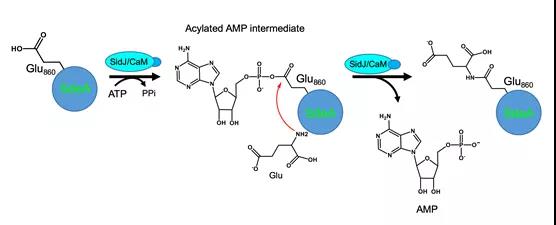
圖3 SidJ-CaM通過形成酰化單磷酸腺苷反應中間物催化谷氨酸化的反應模型。
谷氨酸化修飾此前多見于真核細胞微管蛋白(Tubulin)的修飾,并調控多種重要細胞功能,但是其催化機理如底物識別等機制并不是非常清楚【10,11】。SidJ作為一個CaM依賴的谷氨酸化酶為進一步探討這一家族酶的作用機制提供了一個窗口。該工作是由美國普渡大學羅招慶教授課題組和福建師范大學歐陽松應教授課題組合作完成的。羅招慶教授和歐陽松應教授為本文的共同通訊作者,普渡大學羅招慶教授課題組博士生干寧海、福建師范大學生命科學學院青年教師甄向凱博士、普渡大學劉堯、以及福建師范大學南方生物醫學研究中心一年級碩士生許小龍為共同第一作者。
據悉,《Nature》同期還以背靠背的方式刊登了德國歌德大學(Goethe University)Ivan Dikic教授課題組的研究論文“Inhibition of SidE ubiquitin ligases throughSidJ/Calmodulin catalyzed glutamylation”【12】。美國西南醫學中心的研究人員在《Science》上也發表了類似的研究結果【13】。





